Реконструкція потенціалів дії серцевих клітин з позаклітинних потенціалів поля
DOI:
https://doi.org/10.20535/S0021347022090047Ключові слова:
системи з мікроелектродними решітками, обернена задача електрофізіології, потенціали поля, потенціали дії, лабораторія на чипі, штучні серцеві клітини, кардіотоксичністьАнотація
Ключовими напрямами застосування систем з мікроелектродними решітками (МЕР) є вивчення механізмів захворювань та тестування впливу ліків на організм людини за допомогою технологій «Лабораторія на чипі» на основі досліджень штучно вирощених клітин. Зусилля багатьох вчених спрямовано на обробку та аналіз інформації, отриманої системами з МЕР, що допомагає лікарям у створенні ефективних стратегій лікування. Однак, потенціали поля (ПП) серцевих клітин, зареєстровані МЕР системами у неінвазивних вимірюваннях, дають неповну інформацію для оцінювання іонних струмів, у порівнянні з інвазивними вимірами потенціалу дії (ПД), отриманими за допомогою технології петч-кламп. Дослідження присвячено математичному визначенню взаємозв’язку між сигналами електричної активності кардіоміоцитів: внутрішнього ПД та зовнішнього ПП. У статті запропоновано метод розв’язання оберненої задачі взаємозв’язку між ПД і ПП. Рівняння для передавальних функцій між ПД і ПП отримано на основі теорії поля. В роботі наведено результати моделювання реконструкції ПД з виміряних ПП, що демонструє зміну морфології та параметрів цих сигналів під впливом диметилсульфоксиду (ДМСО). Сигнали ПП зареєстровані шляхом використання неруйнівної електрофізіологічної технології на основі мікроелектродних коаксіальних направляючих (mECG), яка може вважатися різновидом МЕР.
Посилання
P. Garg, V. Garg, R. Shrestha, M. C. Sanguinetti, T. J. Kamp, J. C. Wu, “Human induced pluripotent stem cell–derived cardiomyocytes as models for cardiac channelopathies,” Circ. Res., vol. 123, no. 2, pp. 224–243, 2018, doi: https://doi.org/10.1161/CIRCRESAHA.118.311209.
N. Azizipour, R. Avazpour, D. H. Rosenzweig, M. Sawan, A. Ajji, “Evolution of biochip technology: A review from lab-on-a-chip to organ-on-a-chip,” Micromachines, vol. 11, no. 6, p. 599, 2020, doi: https://doi.org/10.3390/mi11060599.
J. Piñero, L. I. Furlong, F. Sanz, “In silico models in drug development: where we are,” Curr. Opin. Pharmacol., vol. 42, pp. 111–121, 2018, doi: https://doi.org/10.1016/j.coph.2018.08.007.
H.-J. Huang, Y.-H. Lee, Y.-H. Hsu, C.-T. Liao, Y.-F. Lin, H.-W. Chiu, “Current strategies in assessment of nanotoxicity: alternatives to in vivo animal testing,” Int. J. Mol. Sci., vol. 22, no. 8, p. 4216, 2021, doi: https://doi.org/10.3390/ijms22084216.
L. D. Garma et al., “Cost-effective and multifunctional acquisition system for in vitro electrophysiological investigations with multi-electrode arrays,” PLOS ONE, vol. 14, no. 3, p. e0214017, 2019, doi: https://doi.org/10.1371/journal.pone.0214017.
L. G. J. Tertoolen, S. R. Braam, B. J. van Meer, R. Passier, C. L. Mummery, “Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes,” Biochem. Biophys. Res. Commun., vol. 497, no. 4, pp. 1135–1141, 2018, doi: https://doi.org/10.1016/j.bbrc.2017.01.151.
M. Talkhabi, N. Aghdami, H. Baharvand, “Human cardiomyocyte generation from pluripotent stem cells: A state-of-art,” Life Sci., vol. 145, pp. 98–113, 2016, doi: https://doi.org/10.1016/j.lfs.2015.12.023.
P. Mulder et al., “Predicting cardiac safety using human induced pluripotent stem cell-derived cardiomyocytes combined with multi-electrode array (MEA) technology: A conference report,” J. Pharmacol. Toxicol. Methods, vol. 91, pp. 36–42, 2018, doi: https://doi.org/10.1016/j.vascn.2018.01.003.
J. Ma et al., “High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents,” Am. J. Physiol. Circ. Physiol., vol. 301, no. 5, pp. H2006–H2017, 2011, doi: https://doi.org/10.1152/ajpheart.00694.2011.
A. S. T. Smith, J. Macadangdang, W. Leung, M. A. Laflamme, D.-H. Kim, “Human iPSC-derived cardiomyocytes and tissue engineering strategies for disease modeling and drug screening,” Biotechnol. Adv., vol. 35, no. 1, pp. 77–94, 2017, doi: https://doi.org/10.1016/j.biotechadv.2016.12.002.
P. W. Burridge, G. Keller, J. D. Gold, J. C. Wu, “Production of De Novo Cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming,” Cell Stem Cell, vol. 10, no. 1, pp. 16–28, 2012, doi: https://doi.org/10.1016/j.stem.2011.12.013.
S. Casini, A. O. Verkerk, C. A. Remme, “Human iPSC-derived cardiomyocytes for investigation of disease mechanisms and therapeutic strategies in inherited arrhythmia syndromes: Strengths and limitations,” Cardiovasc. Drugs Ther., vol. 31, no. 3, pp. 325–344, 2017, doi: https://doi.org/10.1007/s10557-017-6735-0.
L. A. Annecchino, S. R. Schultz, “Progress in automating patch clamp cellular physiology,” Brain Neurosci. Adv., vol. 2, p. 239821281877656, 2018, doi: https://doi.org/10.1177/2398212818776561.
S. A. Mann et al., “Recording of multiple ion current components and action potentials in human induced pluripotent stem cell-derived cardiomyocytes via automated patch-clamp,” J. Pharmacol. Toxicol. Methods, vol. 100, p. 106599, 2019, doi: https://doi.org/10.1016/j.vascn.2019.106599.
T. J. Herron, P. Lee, J. Jalife, “Optical imaging of voltage and calcium in cardiac cells & tissues,” Circ. Res., vol. 110, no. 4, pp. 609–623, 2012, doi: https://doi.org/10.1161/CIRCRESAHA.111.247494.
M. C. Müllenbroich et al., “Novel optics-based approaches for cardiac electrophysiology: A review,” Front. Physiol., vol. 12, 2021, doi: https://doi.org/10.3389/fphys.2021.769586.
E. Tanumihardja, D. S. de Bruijn, R. H. Slaats, W. Olthuis, A. van den Berg, “Monitoring contractile cardiomyocytes via impedance using multipurpose thin film ruthenium oxide electrodes,” Sensors, vol. 21, no. 4, p. 1433, 2021, doi: https://doi.org/10.3390/s21041433.
M. F. Peters, C. W. Scott, R. Ochalski, Y. P. Dragan, “Evaluation of cellular impedance measures of cardiomyocyte cultures for drug screening applications,” ASSAY Drug Dev. Technol., vol. 10, no. 6, pp. 525–532, 2012, doi: https://doi.org/10.1089/adt.2011.442.
M. F. Peters, S. D. Lamore, L. Guo, C. W. Scott, K. L. Kolaja, “Human stem cell-derived cardiomyocytes in cellular impedance assays: Bringing cardiotoxicity screening to the front line,” Cardiovasc. Toxicol., vol. 15, no. 2, pp. 127–139, 2015, doi: https://doi.org/10.1007/s12012-014-9268-9.
B. Koci et al., “An impedance-based approach using human iPSC-derived cardiomyocytes significantly improves in vitro prediction of in vivo cardiotox liabilities,” Toxicol. Appl. Pharmacol., vol. 329, pp. 121–127, 2017, doi: https://doi.org/10.1016/j.taap.2017.05.023.
C. W. Scott, X. Zhang, N. Abi-Gerges, S. D. Lamore, Y. A. Abassi, M. F. Peters, “An impedance-based cellular assay using human iPSC-derived cardiomyocytes to quantify modulators of cardiac contractility,” Toxicol. Sci., vol. 142, no. 2, pp. 331–338, 2014, doi: https://doi.org/10.1093/toxsci/kfu186.
G. Melle et al., “Intracellular recording of human cardiac action potentials on market-available multielectrode array platforms,” Front. Bioeng. Biotechnol., vol. 8, 2020, doi: https://doi.org/10.3389/fbioe.2020.00066.
M. Dipalo et al., “Plasmonic meta-electrodes allow intracellular recordings at network level on high-density CMOS-multi-electrode arrays,” Nat. Nanotechnol., vol. 13, no. 10, pp. 965–971, 2018, doi: https://doi.org/10.1038/s41565-018-0222-z.
G. C. Messina et al., “Spatially, temporally, and quantitatively controlled delivery of broad range of molecules into selected cells through plasmonic nanotubes,” Adv. Mater., vol. 27, no. 44, pp. 7145–7149, 2015, doi: https://doi.org/10.1002/adma.201503252.
S. R. Braam, L. Tertoolen, A. van de Stolpe, T. Meyer, R. Passier, C. L. Mummery, “Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes,” Stem Cell Res., vol. 4, no. 2, pp. 107–116, 2010, doi: https://doi.org/10.1016/j.scr.2009.11.004.
S. Nachimuthu, M. D. Assar, J. M. Schussler, “Drug-induced QT interval prolongation: mechanisms and clinical management,” Ther. Adv. Drug Saf., vol. 3, no. 5, pp. 241–253, 2012, doi: https://doi.org/10.1177/2042098612454283.
F. Stillitano et al., “Modeling susceptibility to drug-induced long QT with a panel of subject-specific induced pluripotent stem cells,” eLife, vol. 6, 2017, doi: https://doi.org/10.7554/eLife.19406.
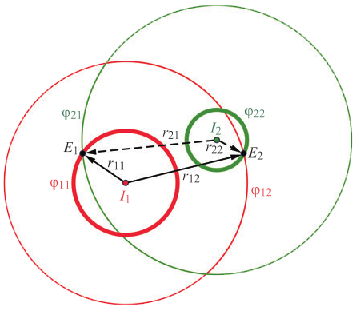
Н. Г. Іванушкіна, К. О. Іванько, М. О. Шпотак, Ю. В. Прокопенко, “Розв’язання оберненої задачі взаємозв’язку між потенціалами дії та потенціалами поля в серцевих клітинах,” Вісник НТУУ “КПІ”. Серія Радіотехніка, Радіоапаратобудування, no. 85, pp. 53–59, 2021, doi: https://doi.org/10.20535/RADAP.2021.85.53-59.
R. Visone et al., “Micro-electrode channel guide (µECG) technology: an online method for continuous electrical recording in a human beating heart-on-chip,” Biofabrication, vol. 13, no. 335026, 2021, doi: https://doi.org/10.1088/1758-5090/abe4c4.
A. O. Verkerk et al., “Single cells isolated from human sinoatrial node: Action potentials and numerical reconstruction of pacemaker current,” in 2007 29th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, 2007, pp. 904–907, doi: https://doi.org/10.1109/IEMBS.2007.4352437.
C. Rickert, C. Proenza, “ParamAP: Standardized parameterization of sinoatrial node myocyte action potentials,” Biophys. J., vol. 113, no. 4, pp. 765–769, 2017, doi: https://doi.org/10.1016/j.bpj.2017.07.001.
M. Verheijen et al., “DMSO induces drastic changes in human cellular processes and epigenetic landscape in vitro,” Sci. Reports, vol. 9, no. 1, p. 4641, 2019, doi: https://doi.org/10.1038/s41598-019-40660-0.
X. Zhang et al., “Multi-parametric assessment of cardiomyocyte excitation-contraction coupling using impedance and field potential recording: A tool for cardiac safety assessment,” J. Pharmacol. Toxicol. Methods, vol. 81, pp. 201–216, 2016, doi: https://doi.org/10.1016/j.vascn.2016.06.004.
H. Ando et al., “A new paradigm for drug-induced torsadogenic risk assessment using human iPS cell-derived cardiomyocytes,” J. Pharmacol. Toxicol. Methods, vol. 84, pp. 111–127, 2017, doi: https://doi.org/10.1016/j.vascn.2016.12.003.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2023 Вісті вищих учбових закладів. РадіоелектронікаИздатель журнала Известия высших учебных заведений. Радиоэлектроника (сокр. "Известия вузов. Радиоэлектроника"), Национальный технический университет Украины "Киевский политехнический институт", учитывает, что доступ автора к его статье является важным как для самого автора, так и для спонсоров его исследований. Мы представлены в базе издателей SHERPA/RoMEO как зеленый издатель (green publisher), что позволяет автору выполнять самоархивирование своей статьи. Однако важно, чтобы каждая из сторон четко понимала свои права. Просьба более детально ознакомиться с Политикой самоархивирования нашего журнала.
Политика оплаченного открытого доступа POA (paid open access), принятая в журнале, позволяет автору выполнить все необходимые требования по открытому доступу к своей статье, которые выдвигаются институтом, правительством или фондом при выделении финансирования. Просьба более детально ознакомиться с политикой оплаченного открытого доступа нашего журнала (см. отдельно).
Варианты доступа к статье:
1. Статья в открытом доступе POA (paid open access)
В этом случае права автора определяются лицензией CC BY (Creative Commons Attribution).
2. Статья с последующим доступом по подписке
В этом случае права автора определяются авторским договором, приведенным далее.
- Автор (каждый соавтор) уступает Издателю журнала «Известия высших учебных заведений. Радиоэлектроника» НТУУ «КПИ» на срок действия авторского права эксклюзивные права на материалы статьи, в том числе право на публикацию данной статьи издательством Аллертон Пресс, США (Allerton Press) на английском языке в журнале «Radioelectronics and Communications Systems». Передача авторского права охватывает исключительное право на воспроизведение и распространение статьи, включая оттиски, переводы, фото воспроизведения, микроформы, электронные формы (он- и оффлайн), или любые иные подобные формы воспроизведения, а также право издателя на сублицензирование третьим лицам по своему усмотрению без дополнительных консультаций с автором. При этом журнал придерживается Политики конфиденциальности.
- Передача прав включает право на обработку формы представления материалов с помощью компьютерных программам и систем (баз данных) для их использования и воспроизводства, публикации и распространения в электронном формате и внедрения в системы поиска (базы данных).
- Воспроизведение, размещение, передача или иное распространение или использование материалов, содержащихся в статье должно сопровождаться ссылкой на Журнал и упоминанием Издателя, а именно: название статьи, имя автора (соавторов), название журнала, номер тома, номер выпуска, копирайт авторов и издателя "© Национальный технический университет Украины "Киевский политехнический институт"; © автор(ы)".
- Автор (каждый соавтор) материалов сохраняет все права собственника материалов, включая патентные права на любые процессы, способы или методы и др., а также права на товарные знаки.
- Издатель разрешает автору (каждому соавтору) материалов следующее:
- Право пользоваться печатными или электронными вариантами материалов статьи в форме и содержании, принятыми Издателем для публикации в Журнале. Подробнее см. политики Оплаченного открытого доступа, подписки и самоархивирования.
- Право бесплатно копировать или передавать коллегам копию напечатанной статьи целиком или частично для их личного или профессионального использования, для продвижения академических или научных исследований или для учебного процесса или других информационных целей, не связанных с коммерческими целями.
- Право использовать материалы из опубликованной статьи в написанной автором (соавторами) книге, монографии, учебнике, учебном пособии и других научных и научно-популярных изданиях.
- Право использовать отдельные рисунки или таблицы и отрывки текста из материалов в собственных целях обучения или для включения их в другую работу, которая печатается (в печатном или электронном формате) третьей стороной, или для представления в электронном формате во внутренние компьютерные сети или на внешние сайты автора (соавторов).
- Автор (соавторы) соглашаются, что каждая копия материалов или любая ее часть, распространенная или размещенная ими в печатном или электронном формате, будет содержать указание на авторское право, предусмотренное в Журнале и полную ссылку на Журнал Издателя.
- Автор (соавторы) гарантирует, что материалы являются оригинальной работой и представлены впервые на рассмотрение только в этом Журнале и ранее не публиковались. Если материалы написаны совместно с соавторами, автор гарантирует, что проинформировал их относительно условий публикации материалов и получил их подписи или письменное разрешение подписываться от их имени.
- Если в материалы включаются отрывки из работ или имеются указания на работы, которые охраняются авторским правом и принадлежат третьей стороне, то автору необходимо получить разрешение владельца авторских прав на использование таких материалов в первом случае и сделать ссылку на первоисточник во втором.
- Автор гарантирует, что материалы не содержат клеветнических высказываний и не посягают на права (включая без ограничений авторское право, права на патент или торговую марку) других лиц и не содержат материалы или инструкции, которые могут причинить вред или ущерб третьим лицам. Автор (каждый соавтор) гарантирует, что их публикация не приведет к разглашению секретных или конфиденциальных сведений (включая государственную тайну). Подтверждением этого является Экспертное заключение (см. перечень документов в Правила для авторов).
- Издатель обязуется опубликовать материалы в случае получения статьей положительного решения редколлегии о публикации на основании внешнего рецензирования (см. Политика рецензирования).
- В случае публикации статьи на английском языке в журнале «Radioelectronics and Communications Systems» (Издатель: Аллертон Пресс, США, распространитель Springer) автору (соавторам) выплачивается гонорар после выхода последнего номера журнала года, в котором опубликована данная статья.
- Документ Согласие на публикацию, который подают русскоязычные авторы при подаче статьи в редакцию, является краткой формой данного договора, в котором изложены все ключевые моменты настоящего договора и наличие которого подтверждает согласие автора (соавторов) с ним. Аналогичным документом для англоязычных авторов является Copyright Transfer Agreement (CTA), предоставляемый издательством Allerton Press.
- Настоящий Договор вступает в силу в момент принятия статьи к публикации. Если материалы не принимаются к публикации или до публикации в журнале автор (авторы) отозвал работу, настоящий Договор не приобретает (теряет) силу.



